Στη δομή του νέου ευρωπαϊκού οργανισμού ΗΤΑ αλλά και στις επιπτώσεις του νέου ευρωπαϊκού κανονισμού HTA στην καινοτομία, αναφέρθηκε η πρόεδρος της Ευρωπαϊκής Ομάδας Συντονισμού ΗΤΑ Róisin Adams, μιλώντας στο συνέδριο ΗΤΑ.
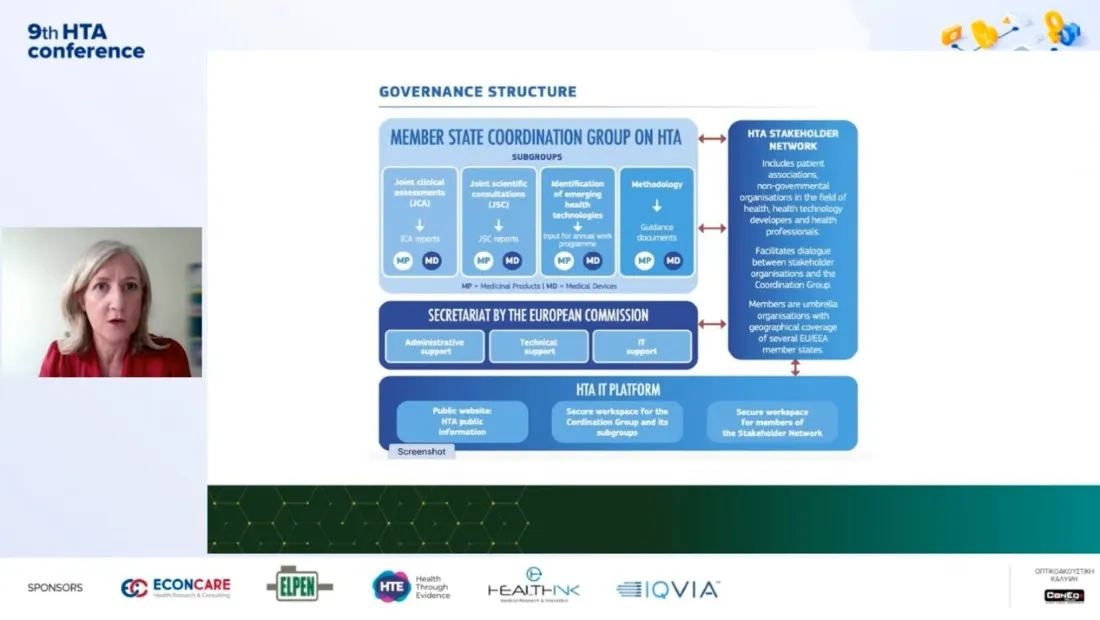
Αναφερόμενη στους λόγους που χρειαζόμαστε ένα κοινό κανονισμό ΗΤΑ στην Ευρώπη, σημείωσε την ανισότητα στην πρόσβαση στην καινοτομία για τους ασθενείς στην Ευρώπη, τις διαφορετικές διαδικασίες ΗΤΑ σε κάθε χώρα, καθώς και τους φακέλους δεδομένων που για αρκετές ρυθμιστικές αρχές δεν περιέχουν αρκετά στοιχεία για να πάρουν αποφάσεις. Όπως ανέφερε η ευρωπαϊκή οργανωτική δομή ΗΤΑ αποτελείται από την Ομάδα Συντονισμού (coordination group) στην οποία εκπροσωπούνται όλα τα κράτη μέλη και 4 υποομάδες που έχουν σαν αντικείμενο η πρώτη τις κοινές κλινικές αξιολογήσεις , η δεύτερη τις κοινές επιστημονικές διαβουλεύσεις, η τρίτη τις αναδυόμενες τεχνολογίες υγείας (Horizon Scanning ) και η τέταρτη την μεθοδολογία. Όλο αυτό το σύστημα έχει γραμματειακή υποστήριξη από την Κομισιόν, ενώ υπάρχει και η πλατφόρμα ΙΤ στην οποία έχουν πρόσβαση επαγγελματίες υγείας, ασθενείς, ανεβαίνουν αναφορές κλπ. Το coordination group λαμβάνει και την τελική απόφαση ενώ βρίσκεται σε στενή αλληλεπίδραση με το δίκτυο των stakeholders (συλλόγους ασθενών, οργανώσεις επαγγελματιών υγείας, Μη Κυβερνητικές Οργανώσεις, φαρμακοβιομηχανίες ). Η Ελλάδα εκπροσωπείται στην Ομάδα Συντονισμού (coordination group) από τις κκ Φλώρα Μπακοπούλου και Χαρά Κανή, αλλά και στις 4 υποομάδες. Ο Ευρωπαϊκός Κανονισμός ΗΤΑ προβλέπει ότι σε ευρωπαϊκό επίπεδο θα αξιολογούνται φάρμακα για τα οποία θα γίνεται μόνο κλινική αξιολόγηση, ενώ η μη κλινική αξιολόγηση (οικονομικά, δεοντολογικά ζητήματα) θα γίνεται σε επίπεδο κρατών.
Η Ευρωπαϊκή Επιτροπή είναι υπεύθυνη για 4 νομοθετικές ρυθμίσεις μέχρι το τέλος του 2025. Στις 12 Ιανουαρίου του 2025 θα ανακοινωθούν οι πρώτες αξιολογήσεις που θα αφορούν ογκολογικά φάρμακα, ενώ το 2026 θα αρχίσει και η αξιολόγηση των ιατροτεχνολογικών προϊόντων. Το 2028 στην αξιολόγηση θα ενταχθούν και τα ορφανά φάρμακα ενώ το 2030 θα ενταχθούν όλα τα φάρμακα για όλες τις ασθένειες.
Όσον αφορά την διαδικασία ΗΤΑ στην Ελλάδα, η Róisin Adams ανέφερε ότι είναι η ώρα για να οργανωθούν οι διαδικασίες αξιολόγησης, νε εκπαιδευτούν οι αξιολογητές , να αποφασιστεί τι είναι σημαντικό για τι χώρα (ανάγκες, ελλέιψεις κλπ) και εάν υπάρχει ανάγκη να γίνουν και αλλαγές στη νομοθεσία. Ελπίζουμε ότι μετά το 2025, σε όλες τις χώρες της ΕΕ θα υπάρχει πιο γρήγορη και ισότιμη πρόσβαση στην καινοτομία και ένα στιβαρό και ολοκληρωμένο σύστημα Αξιολόγησης Τεχνολογιών Υγείας, δήλωσε η Róisin Adams.
Απαντώντας σε ερώτηση του καθηγητή Ιωάννη Υφαντόπουλου, Ακαδημαϊκός Συντονιστής MBA με ειδίκευση την Διοίκηση Υπηρεσιών Υγείας, σχετικά με το αν θα υπάρξουν διαφορετικές οδηγίες και προσεγγίσεις σε κάθε κράτος μέλος της ΕΕ, δεδομένης της διαφορετικότητας των συστημάτων Υγείας, της διαφορετικής οικονομικής κατάστασης του κάθε κράτους μέλους κλπ, η αν ο κανονισμός θα είναι κοινός για όλα τα κράτη μέλη, η Róisin Adams απάντησε ότι στόχος της Ευρωπαϊκής Επιτροπής ΗΤΑ είναι ότι οδηγία εκδοθεί να προσαρμόζεται σε όλα τα συστήματα υγείας καθώς να δώσει την ίδια πληροφορία σε όλα τα συστήματα υγείας. Ωστόσο, κατέληξε, η τελική απόφαση θα λαμβάνεται σε εθνικό επίπεδο.
Πηγή: healthdaily.gr