Blog
Blog
Η Novartis λαμβάνει από τον FDA χαρακτηρισμό διαδικασίας ταχείας αξιολόγησης (fast track designation) για το sabatolimab
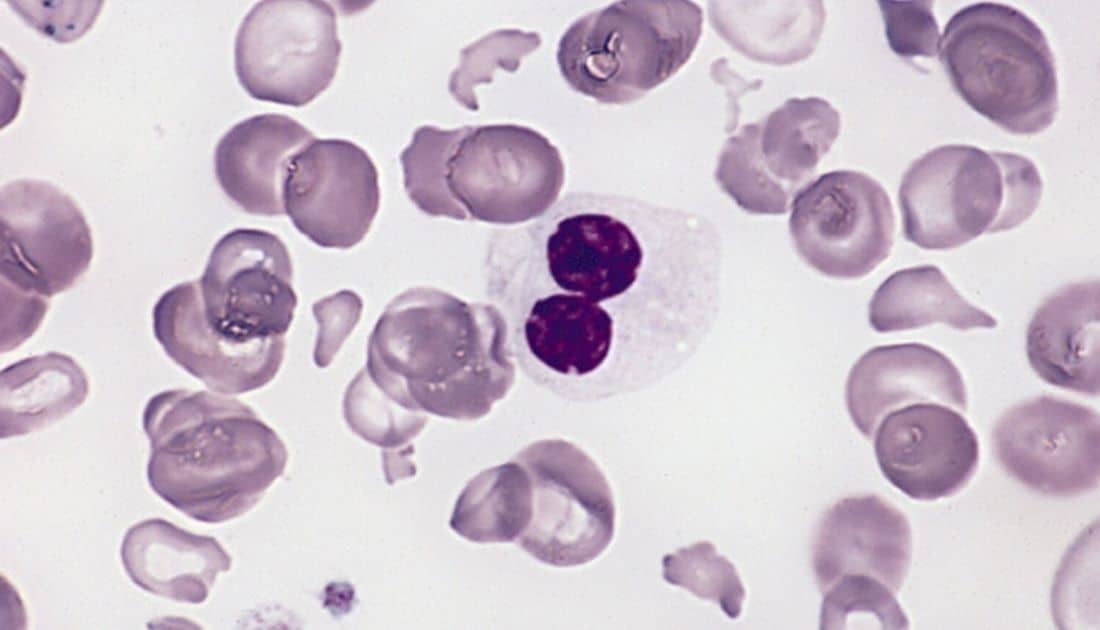
Η Novartis ανακοίνωσε ότι έλαβε από τον Οργανισμό Τροφίμων και Φαρμάκων των ΗΠΑ (FDA) τον χαρακτηρισμό διαδικασία ταχείας αξιολόγησης (fast track designation) του sabatolimab (MBG453) για τη θεραπεία ενηλίκων ασθενών με μυελοδυσπλαστικά σύνδρομα (MDS) υψηλού ή πολύ υψηλού κινδύνου κατά IPSS-R, σε συνδυασμό με υπομεθυλιωτικούς παράγοντες. Ο χαρακτηρισμός διαδικασίας ταχείας αξιολόγησης διευκολύνει την ανάπτυξη και επιταχύνει την αξιολόγηση των φαρμάκων για τη θεραπεία σοβαρών παθήσεων και την κάλυψη ανεκπλήρωτων ιατρικών αναγκών.
- Τα MDS, μια ομάδα σπάνιων και συχνά υποδιαγνωσμένων αιματολογικών καρκίνων, χαρακτηρίζονται από δυσλειτουργία του ανοσοποιητικού συστήματος και πολλαπλασιασμό λευχαιμικών βλαστών,
- Παρά τη θεραπεία με υπομεθυλιωτικούς παράγοντες (HMA) – την τελευταία θεραπευτική καινοτομία εδώ και 15 χρόνια για τα υψηλότερου κινδύνου MDS – οι ασθενείς επιδεικνύουν κακές εκβάσεις, όπως περιορισμένη διάρκεια ανταπόκρισης, ενώ ο διάμεσος χρόνος συνολικής επιβίωσής τους είναι κάτω από ένα έτος.
- Το sabatolimab είναι μια υπό έρευνα, πρώτη στην κατηγορία της, ανοσο-μυελική θεραπεία που συνδέεται με τον TIM- 3, ένα νέο στόχο που εκφράζεται σε πολλούς τύπους ανοσοκυττάρων και λευχαιμικών κυττάρων και βλαστών, αλλά όχι στα φυσιολογικά αρχέγονα κύτταρα που είναι υπεύθυνα για την αιμοποίηση. Είναι υπό ανάπτυξη για τα MDS υψηλού κινδύνου και την οξεία μυελογενή λευχαιμία (AML)
Το πρόγραμμα κλινικών δοκιμών STIMULUS περιλαμβάνει πολλές μελέτες αξιολόγησης του sabatolimab ως μέρους διαφορετικών θεραπευτικών συνδυασμών σε ασθενείς με MDS και AML, συμπεριλαμβανομένων των μελετών STIMULUS-MDS1 Φάσης ΙΙ, STIMULUS-MDS2 Φάσης III, STIMULUS-MDS3 Φάσης ΙΙ, STIMULUS-AML1 Φάσης ΙΙ.
Πηγή: healthdaily.gr